这是一个革命性的研究成果:科学家首次发现了手性纳米材料作为免疫佐剂,高效介导细胞免疫应答和体液免疫应答,为未来疫苗研发提供了全新的理念。
2022年1月19日,江南大学胥传来研究团队与美国密歇根大学Kotov课题组以及巴西圣保罗大学等合作,在Nature期刊正文发表题为“Enantiomer-dependent immunological response to chiral nanoparticles”的研究论文。研究成果揭示了独特手性纳米材料作为免疫佐剂能均衡地介导体液免疫应答和细胞免疫应答,不但为保护性疫苗研发提供了理论支撑,而且为治疗性疫苗的研发指明了方向。《自然》杂志同期刊发了“News & Views”评论文章重点推荐介绍了这项工作(https://www.nature.com/articles/d41586-021-03806-7)
手性是指物体与其镜像无法重合的现象,存在于从微观到宏观上的各个尺度。手性对生命起源和生命体系的重要意义,众所周知,生命选择相同手性的L-氨基酸和相同手性的D-核糖或D-脱氧核糖来构筑蛋白质、核酸等生物大分子。金属元素在很多生命过程中都发挥重要的作用,是人体中必不可少的成分。比如铝佐剂自1926年以来,一直用于人类疫苗的研制。
纳米材料无论从尺度、组成还是表面性质来看,与生物大分子都具有极高的相似性。在该工作中,研究团队研制了各向异性因子达0.44的强手性纳米金材料,研发发现左手性纳米佐剂,使得肿瘤坏死因子-α、γ-干扰素、白介素-12等细胞因子的表达量提升了1~2倍,既有效促进天然免疫应答和细胞免疫应答,又高效介导体液免疫应答,产生抗体的滴度是传统商业化铝佐剂的800余倍,是右手性纳米佐剂的1580余倍,为抗病毒、抗肿瘤疫苗研发提供了新思路。
传统疫苗佐剂主要是以铝的无机盐为主,铝佐剂与人体免疫系统之间的作用机制尚未完全清楚;长期以来大多数佐剂被国外制药公司,如葛兰素史克和赛诺菲等控制,我国疫苗中所使用的铝佐剂依赖进口。但铝佐剂只能激活体液免疫,无法有效激活人体的细胞免疫应答,因而抗病毒感染疫苗的保护效果非常有限,而且铝佐剂形成的疫苗还有一个缺点就是不能冻融,所以对生产、储存以及运输都有极高的要求。此外,铝佐剂潜在的神经毒性可能诱导产生儿童自闭症、皮肤淋巴组织增生症等相关不良反应已被广泛报道。因此,发展新型、安全的佐剂,对于新型、高效疫苗的研发意义重大。
该研究表明,手性免疫佐剂通过与免疫细胞表面的CD97等分子亲和,进入细胞,激活炎症小体通路,促进了抗原呈递细胞对于抗原的吞噬效率。手性免疫佐剂活化抗原呈递细胞分泌多种细胞因子,有效激活了细胞免疫应答和体液免疫应答,刺激机体产生了强有力的免疫应答,能更好地预防感染,并带来持久的保护效果。
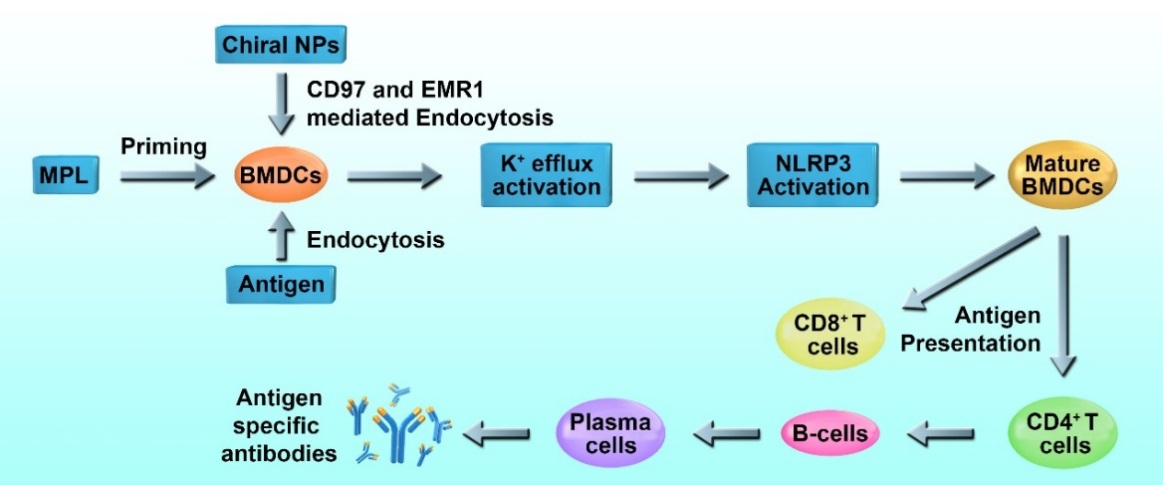
手性纳米佐剂激活免疫应答的机理图
通过手性调控机体免疫应答为未来为新型疫苗佐剂研发找到了根本性突破口,该研究的通讯作者胥传来教授说:「过去的研究主要强调候选抗原或抗原基因的研究,我们的研究从某种程度上来说,颠覆了传统的观念,实现了从“0到1”的源头创新。」
胥传来教授表示:“通过手性纳米佐剂调控免疫应答,意味着我们可以通过手性材料高效地调控中和抗体滴度和T细胞免疫应答。 全球对于保护性疫苗的研发已有较多经验,而对于治疗性疫苗,尤其是抗肿瘤疫苗的研发一直未有满意效果。该研究为慢性感染、肿瘤等疾病的治疗提供了全新的研发思路。”

(胥传来)

(胥传来教授指导博士研究生)
「在实验过程中为了去除手性分子的影响,我们采用非手性的巯基化试剂去除了颗粒表面的手性配体。同时,采用人源化细胞对实验结果进行了验证,发现手性纳米材料能高效进入人源树突状细胞吞噬促进其成熟活化,产生系列细胞因子,显示了手性纳米材料作为疫苗佐剂的潜力。」论文第一作者徐丽广表示。

(徐丽广)
研究团队表示,该项研究的亮点有以下三个方面:
· 偏振光合成强手性纳米佐剂:在强手性纳米材料合成方面,在制备过程中引入偏振光,在高指数晶面上形成对称性破缺,实现了镜像强手性纳米佐剂的精准合成。研究人员筛选了系列手性配体,并与不同波长偏振光优化组合,最终获得了表面形貌均一,各向异性因子高达0.44的强手性金纳米佐剂。
· 发现了手性纳米佐剂进入免疫细胞机制:通过冷冻电镜、光谱和蛋白分析,研究团队发现并证实 CD97和EMR1这两种七次跨膜蛋白介导了手性纳米佐剂进入细胞的机制。研究表明左手性纳米佐剂与CD97的亲和力是右手性材料的14倍,进入细胞的速率是右手性佐剂的2倍。
· 发现了手性纳米佐剂介导免疫应答的机制:研究团队发现免疫细胞的活化与手性纳米佐剂的手性强弱呈现一定的正相关性。手性纳米材料通过激活炎症小体NLRP3途径以及调控细胞因子表达模式,有效介导了细胞免疫应答和体液免疫应答。
研究团队介绍
胥传来教授为该论文的通讯作者,美国密歇根大学Nicholas A. Kotov教授以及江南大学食品科学与技术国家重点实验室匡华教授为共同通讯作者。江南大学食品学院青年教师徐丽广和2018级博士生王秀秀为该文章的共同第一作者,这项工作得到了美国密歇根大学Nicholas A. Kotov教授、巴西纳米技术国家实验室的Felippe M. Colombari教授、巴西圣保罗大学的Andre F. de Moura教授在动力学模拟与计算等方面的大力帮助。该研究得到了国家自然科学基金委(21925402, 32071400, 21977038, 92156003)、江苏省前沿基础(BK20212014)等项目的资助。

(研究团队)
论文链接:www.nature.com/articles/s41586-021-04243-2
